El diamante es un material fascinante, en cierta medida “el rey de los cristales”. No sólo es la gema más cara y el material más duro conocido sino que además, es parte de una familia de estructuras cristalinas formadas exclusivamente por átomos de carbono y con propiedades tan asombrosas y valiosas como el mismo diamante. Esta familia de polimorfos, es decir, de cristales de la misma composición química pero de distinta estructura, incluye el grafito y también los fulerenos, los nanotubos de carbono y el grafeno. Todos ellos son formas diferentes de ordenar los átomos de carbono y algunos pueden jugar un papel muy relevante en la historia de la humanidad.
¿Sabes que relación existe entre las distintos polimorfos del carbono? ¿Te has preguntado cómo se valora la calidad de un diamante? ¿Sabes que una lámina bidimensional de un metro cuadrado de grafeno es capaz de soportar el peso de cuatro kilogramos?
La importancia de la estructura cristalina de un compuesto es crucial para sus propiedades y nada mejor que el diamante y el grafito para entenderlo. Ambos son dos trozos de carbón, es decir están formados ambos por átomos de carbono. Sin embargo uno es un material barato que usamos entre otras cosas para dibujar ya que es el material que se usa como mina de los lápices. Mientras que el otro, el diamante, es el material más preciado, el invencible según la etimología de su nombre – adamas – el material de mayor dureza conocido, el mineral al que ningún otro es capaz de rayar.

Fotografía de diamante con talla brillante. Crédito de la foto: Mario Sarto

Imagen evocativa de la cristalografía de un lápiz. De la mina nacen otros lápices que parecen cristales hexagonales de grafito. Fotografía de Christpher White
La diferencia entre el diamante y el grafito está en la estructura y por ende en la forma en que están enlazados los carbonos. En el diamante, esa estructura es extremadamente compacta. Los cristalógrafos decimos que pertenece al sistema cúbico. En esa estructura todos los átomos de carbono enlazados por fuertes enlaces covalentes lo que hace que sea un material muy duro, el más duro que se conoce.
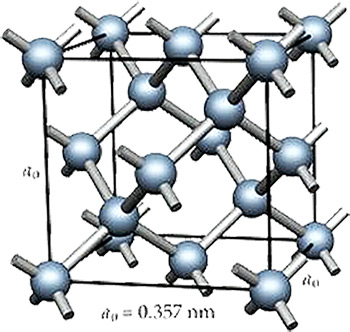
Estructura cúbica del diamante en el que todos los átomos de carbono están unidos entre si por fuertes enlaces covalentes
La estructura del grafito es muy diferente a la del diamante. En el grafito, los átomos de carbono están distribuidos en capas. Dentro de cada capa, cátomo de carbono está unido a otros tres formando hexágonos. Esos tres enlaces son fuertes enlaces covalentes del mismo tipo que los de la estructura del diamante. Pero entre capa y capa, los átomos de carbono están enlazados por unos enlaces más débiles, por las llamadas fuerzas de Van der Waals.
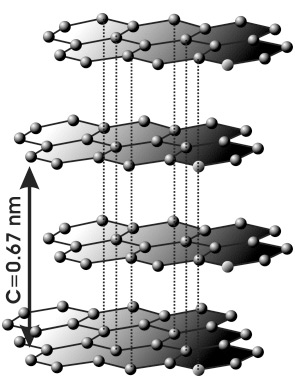
Estructura laminar del grafito. Los átomos en las capas están unidos por fuertes enlaces covalentes pero las fuerza que unen los átomos de carbono entre capa y capa son débiles fuerzas de Van der Waals.
Esta estructura es ideal para entender el concepto de anisotropía en los cristales, es decir, la variación de las propiedades de un cristal con la dirección en la que se mida. La cohesión de los átomos en cualquiera de las direcciones contenidas en las capas de hexágonos es extraordinaria por lo que será muy difícil separarlos unos de otros. Pero la cohesión entre las capas, es decir en cualquier dirección fuera de las capas de hexagonales será mucho más débil. Las capas se separarán muy fácilmente. Tanto que si hacemos presión con un cristal de grafito sobre un papel, las capas se separarán y quedarán adheridas al papel. Es el lápiz de grafito.
Además del grafito y el diamante, los átomos de carbono pueden agruparse formando otras estructuras que tienen una gran importancia científica y tecnológica. Hace unos años, dos investigadores rusos, Andre Geim and Konstantin Novoselov, se entretuvieron en separar con cinta adhesiva las láminas hexagonales del grafito. La idea era lograr separar una sola lámina. Con paciencia lo hicieron y le pusieron un nombre: grafeno. Esas capas de átomos de carbono distribuidos hexagonalmente tienen unas propiedades sorprendentes y en ellas están puestas muchas esperanzas de nuestro futuro tecnológico. Ese descubrimiento les valió el premio Nobel. Si quiere conocer más sobre el grafeno le recomendamos esta visitar la página web del Comité Nobel donde encontrará información básica sobre el grafeno y también información avanzada. En buena medida podríamos decir que el grafeno es un diamante bidimensional. Es decir un material ultrafino con las propiedades del diamante: extremadamente duro, mejor conductor eléctrico que el cobre, mejor conductor del calor que cualquier otro material, tan denso que ningún gas lo puede atravesar, y además flexible.
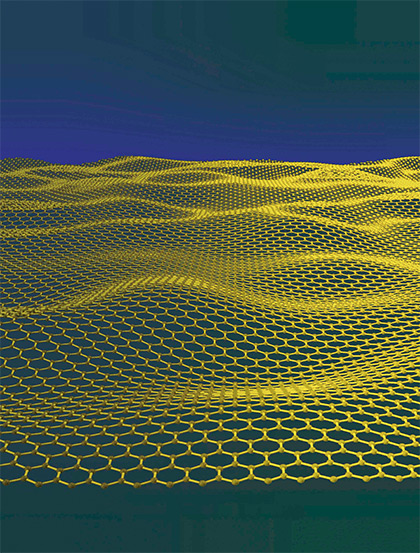
Modelo de la estructura del grafeno.
Otras estructuras interesantes que forman los átomos de carbono son los fulerenos y los nanotubos.
Diamantes sintéticos
El diamante es la joya que más se ha resistido a ser sintetizada pero desde la segunda mitad del siglo XX se sabe como hacerlo. Al principio se usaron métodos de muy alta presión pero hoy en día se utilizan métodos que combinan las altas temperaturas, una cierta presión y el uso de una semilla sobre la que se inicie el crecimiento a partir del carbono disuelto en un fundente. Si quiere conocer cómo se fabrican los diamantes sintéticos en los Estados Unidos le recomendamos el siguiente video:
Aunque cuando se habla del diamante todos pensamos en las costosísimas joyas, los cristales de diamante tienen muchas otras aplicaciones, por ejemplo como abrasivo, y para herramientas de corte. La mayoría de los diamantes sintéticos son muy pequeños y se usan en la industria. Pero en los últimos años se están produciendo diamantes de calidad joya de varios quilates de tamaño, para su uso en joyería. La técnica ha sido desarrollada especialmente en Rusia, en al área tecnológica de Novosibirsk pero la técnica está ya muy extendida.

Diamantes sintéticos.
Pero, aunque parezca increíble, se pueden fabricar y de hecho se fabrican industrialmente diamantes a presión atmosférica. Los descubridores del método fueron unos científicos rusos considerados unos ilusos durante un tiempo, puesto que siempre se creyó que sólo era posible fabricar diamantes a altas temperaturas y presiones. Pero tenían razón y hoy se fabrican diamantes a partir de metano con la ayuda de microondas que crean una atmosfera de plasma de hidrogeno. Realmente se produce mucho grafito y muy poco diamante pero el hidrogeno disuelve el grafito y quedan extrafinas películas delgadas de pocos cientos de micras de espesor. Esas películas se usan en la fabricación de altavoces, en recubrimientos para cubrir supermateriales con una capa química y mecánicamente resistente. El diamante es un excelente conductor del calor, por lio que se están tratando de crear diamantes semiconductores como alternativa al silicio.
¿Sabías que…?
- Los colores de muchas gemas no se deben a pigmentación sino a la existencia de defectos en la estructura cristalina, los llamados centros de color, que no son otra cosa que defectos cristalinos.
- La calidad (y por tanto el precio) de un diamante depende de lo que se conoce como “las cuatro ces”. De hecho son cuatro ces si se nombran esas cualidades en inglés. No son otras que el peso (los quilates o Carats), la transparencia (Clarity) la talla (Cut) y el color (Colour). Estas cuatro propiedades que condicionan el valor de un diamante dependen todas ellas de la cristalografía del diamante. Para más información vea esta web.
- El grafeno es uno de los materiales más prometedores para el futuro. Es unas 200 veces más resistente que el acero, conduce el calor y la electricidad mejor que el silicio y no es fragil como éste.
- Actualmente, el precio del grafeno es muy alto. un centímetro cuadrado cuesta unos 8 euros. Para que empecemos a ver productos tecnológicos de consumo generalizado basados en grafeno, este precio deberá bajar considerablemente, al menos hasta 10 céntimos por centímetro cuadrado.
Para saber más…
- La pagina web de Wikipedia sobre el diamante es la mejor fuente para empezar a conocer más sobre el rey de los minerales. La Wikipedia en inglés tambien tiene una página específicamente dedicada al efecto de los defectos cristalinos sobre las propiedades del diamante.
- Para conocer más sobre el grafeno, les sugerimos la página web de uno de sus descubridores, A. K. Geim, o esta otra de la Universidad de Columbia.
- Además del grafeno, otras formas bidimensionales de carbono ordenado resultan muy prometedoras como nuevos materiales. Antes del grafeno, ya se conocian y se investigaban los nanotubos de carbono y los fulerenos.
- En la página web de wikipedia sobre el polimorfismo puedes aprender sobre la capacidad de un material sólido de existir en más de una forma o estructura cristalina.