La cristalografía jugó un papel crucial en el descubrimiento de la estructura en doble hélice del ADN (ácido desoxirribonucleico) gracias a la interpretación de los diagramas de difracción de rayos X realizados por Rosalind Franklin. La cristalografía de rayos X sigue desvelando la estructura de muchas otras moléculas biológicas, cada vez de mayor complejidad, que nos ayudan a descubrir el misterio de la vida.
¿Sabes cómo se ha logrado conocer las estructuras de esas macromoléculas? ¿Te has preguntado qué importancia tiene para la biomedicina conocer la relación entre la estructura y la función que desarrollan las biomoléculas?

El nacimiento de una ciencia
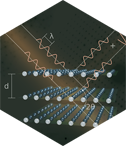
En 1953 se realizó uno de los descubrimientos que marcaron la ciencia de la segunda mitad del siglo XX y el futuro de la biología y la medicina. James Watson y Francis Crick en Oxford y Rosalind Franklin y Maurice Wilkins en Cambridge andaban buscando resolver la estructura del ácido desoxirribonucleico, el ADN. Ambos habían purificado y cristalizado el ADN pero los mejores diagramas de difracción de rayos X los había obtenido Rosalind Franklin, entre ellos su diagrama 51, que mostraba que la estructura debía ser una doble hélice. Esa foto 51 sirvió de inspiración a Watson y Crick para interpretar de forma precisa y correcta cómo los azucares, las bases y los fosfatos se ensamblaban en esa doble hélice.

Izda: Patrón de difracción de la forma B del ADN tomada por Rosalind Franklin. Ctro: Francis Crick y James Watson con su propuesta de estructura del ADN. Dcha: Estructura de la doble hélice del ADN.
Fue un trabajo genial que asombró al mundo científico. Además en este caso resultaba evidente la importancia de la cristalografía, puesto que ninguna molécula mejor que el ADN para explicar la relación entre estructura y función. Todo el mundo entendió lo que los propios autores del trabajo concluían, que “el apareamiento específico que hemos postulado sugiere inmediatamente un posible mecanismo de copia del material genético». Había una relación clara entre las estructuras de las macromoléculas biológicas y la función que realizaban en el organismo. Había nacido una nueva ciencia: la biología estructural.
Watson, Crick y Wilkins recibieron el Premio Nobel de Química en 1962. Rosalind Franklin había fallecido cuatro años antes.
El problema de la cristalización.
Para resolver cualquier estructura macromolecular han de obtenerse en primer lugar sus cristales. Hay que cristalizarla. Se hace a partir de disoluciones de esas substancias, ya sean proteínas, ácidos nucleicos o grandes complejos macromoleculares. Desgraciadamente la cristalización es tan complicada que a veces es el cuello de botella de los grandes proyectos de Biología estructural y de Biomedicina. En 1946 James Batcheller Dummer recibió el Premio Nobel de por el descubrimiento de la cristalización de las proteínas y en 1988 Hartmut Michel compartió el Premio Nobel de Química por su contribución a la cristalización de las proteínas de membrana y en concreto a la del centro de reacción fotosintético.

Izda: Cristales de taumatina en una capilar de contradifusión. Dcha: Cristal de apoferritina obtenido en geles de agarosa.
La anchura de estos cristales es de 800 micras. Hoy se usan cristales de tan solo una pocas micras para obtener los diagramas de difracción de rayos X.
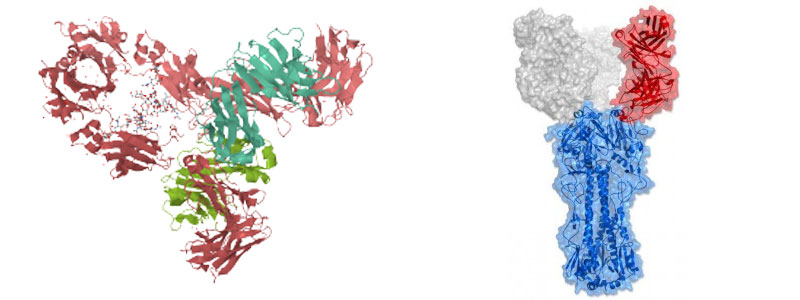
Izda: Estructura del anticuerpo humamo IgG1 b12 que reconoce sitios específicos del virus de inmunodeficiencia HIV-1 y es capaz de neutralizarlo. Este anticuerpo ha sido estudiado para el desarrollo de vacunas contra el sida. Dcha: El C05 es un anticuerpo que se une a una proteína de la cubierta del virus de la gripe (representada en la figura iluminada en color rojo) y que es muy eficaz y selectivo, por lo que se está investigando con vistas a encontrar mejores vacunas contra las versiones más peligrosas de la gripe..
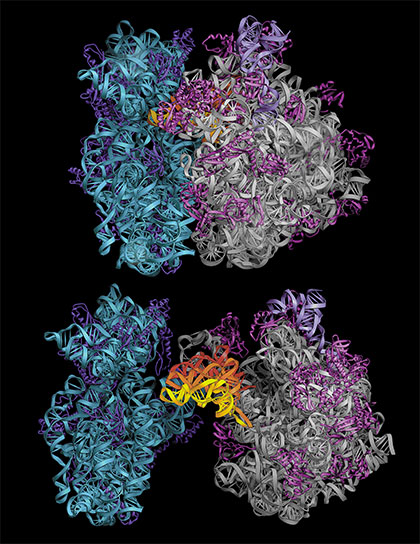
Los ribosomas son grandes complejos macromoleculares compuestos por ácido ribonucleico y proteínas responsables de la producción de proteínas en todas las células vivas. Su tamaño es enorme. Para hacerse una idea de su tamaño y complejidad compare la masa de una molécula de cloruro sódico, que es de 60 Dalton (Da), con una de penicilina de 350 Da, incluso con la insulina humana de unos 5.800 Da, con el peso molecular del ribosoma que es de 2.500.000 Da. La comprensión de los procesos síntesis de proteínas en el ribosoma, de su posterior plegado y de su degradación en el proteosoma están permitiendo avanzar en el entendimiento de enfermedades neurodegenerativas como el Alzheimer. Resolver la estructura de esta inmensa máquina molecular ha sido uno de los últimos logros de la cristalografía. El Premio Nobel de Química de 2009 fue concedido a Venkatraman Ramakrishnan, Thomas A. Steitz y Ada E. Yonath por sus estudios sobre la estructura y función del ribosoma.
Minidocumental sobre la vida y el trabajo de Ada E. Yonath
¿Sabías que…?
- En la controversia sobre los meritos relativos de Rosalind Franklin, Francis Crick y James Watson, suele olvidarse una cuarta figura, Raymond Gosling, científico del King’s College, al que Rosalind Franklin fue asignada como supervisora cuando ésta llegó al laboratorio en 1951. Trabajando juntos produjeron las primeras fotografias de difracción de la forma B del ADN, incluyendo la famosa «Fotografia 51» que finalmente llevaria al descubrimiento de la estructura del ADN.
- El descubrimiento de la estructura del ADN llevó al «Dogma Central» de la biología molecular que dice que la información pasa del ADN al ARN, pero no al reves. Apenas 20 años despues, Howard Martin Temin y David Baltimore descubrieron la transcripción reversa o retrotranscripción, un proceso que implica la generación de una cadena de ADN a partir de un ARN. La ciencia es así, no se para ni ante los «dogmas».
- El estudio de las moléculas de la vida es largo, complejo y costoso… Y el éxito no está grantizado. El los estudios de proteómica, se empieza produciendo las proteinas que queremos investigas (clonación y expresión), de estas proteínas, sólo conseguimos purificar la mitad (50%) y, de estas, tan sólo es posible cristalizar la mitad (25%). De los cristales obtenidos, sólo la mitad son suficientemente buenos para obtener datos de difracción (12%). Afortunadamente con datos de difracción ya no es tan dificil resolver la estructura, algo que se consigue en el 75% de los casos, lo que hace que, tras el proceso, consigamos averiguar la estructura de aproximadamente un 10% de las proteinas iniciales…
Para saber más…
- Puedes aprender más sobre la estructura del ADN.
- Rosalind Elsie Franklin, quimica y cristalógrafa inglesa, autora de importantes contribuciones para la comprensión de la estructura del ADN.
- Puedes aprender más acerca de en qué consiste la biología estructural.
- Puedes conocer los diferentes métodos de cristalización de proteínas que se utilizan.
- El grupo de Cristalografia Macromolecular del IFQR de Madrid tiene unas interensantes páginas didácticas sobre cristalografía donde puedes aprender más sobre como se resuelven las estructuras de las moléculas de la vida.